当每天早晨醒来,我们从睡眠转为觉醒状态后,需要迅速提升警觉性和能量水平,从而更好地应对日常生活中的各种挑战和压力。个体觉醒后约30-40分钟左右,体内皮质醇会快速上升到峰值(约50-160%),随后逐渐回落,到午后趋于较低的平稳状态。这种晨起反应被称为“皮质醇觉醒反应(Cortisol Awakening Response, CAR)”或“压力激素觉醒反应”(如图1)。压力激素觉醒反应CAR在人类中具有独特的生理和心理价值,帮助个体在复杂环境中保持高效的情绪与执行功能。与其他物种相比,人类的 CAR 反应更加显著,受到生物节律、心理和社会因素的调节,并在健康研究和应用中发挥重要作用。自1997年首次报道以来,科学家对CAR进行了广泛的研究,并将其应用于临床和心理学领域,以帮助诊断和治疗各种心理和生理疾病。
近日,北京师范大学认知神经科学与学习国家重点实验室、北京师范大学-IDG/麦戈文脑科学研究院秦绍正团队,在前期系列研究的工作基础上[1-7],结合经典情绪与认知任务范式、动态脑网络建模和心理药物调控,揭示了压力激素觉醒反应(CAR)通过灵活调配神经资源分配,影响人脑功能脑网络动态重组并支持个体行为表现的神经机制。研究发现CAR通过介导灵活的神经资源分配从而影响情绪和执行控制中核心脑网络的动态重组,进而支持高效的情绪与执行功能的加工。该研究从神经系统与内分泌系统融合的新视角,揭示出CAR在人体应变稳态(allostasis)中的潜在调节机制,为理解人体神经系统与内分泌系统如何协同支持高度复杂且灵活的情绪与执行功能具有重要的启示意义。该研究工作12月16日在线刊登于Proceedings of the National Academy of Sciences of the United States of America(PNAS)。
该研究受到科技创新2030-“脑科学与类脑研究”重大项目、国家自然科学基金委重点项目、国家社科基金重大项目、北京师范大学认知神经科学与学习国家重点实验室开放课题和中央高校基本科研业务费专项资金等支持。第一作者为博士毕业生曾奕萌,其它作者依次为熊炳森、高洪尧、陈昌明教授(重师大)、刘超教授(北师大)、吴建辉教授(深圳大学),通讯作者为秦绍正教授。
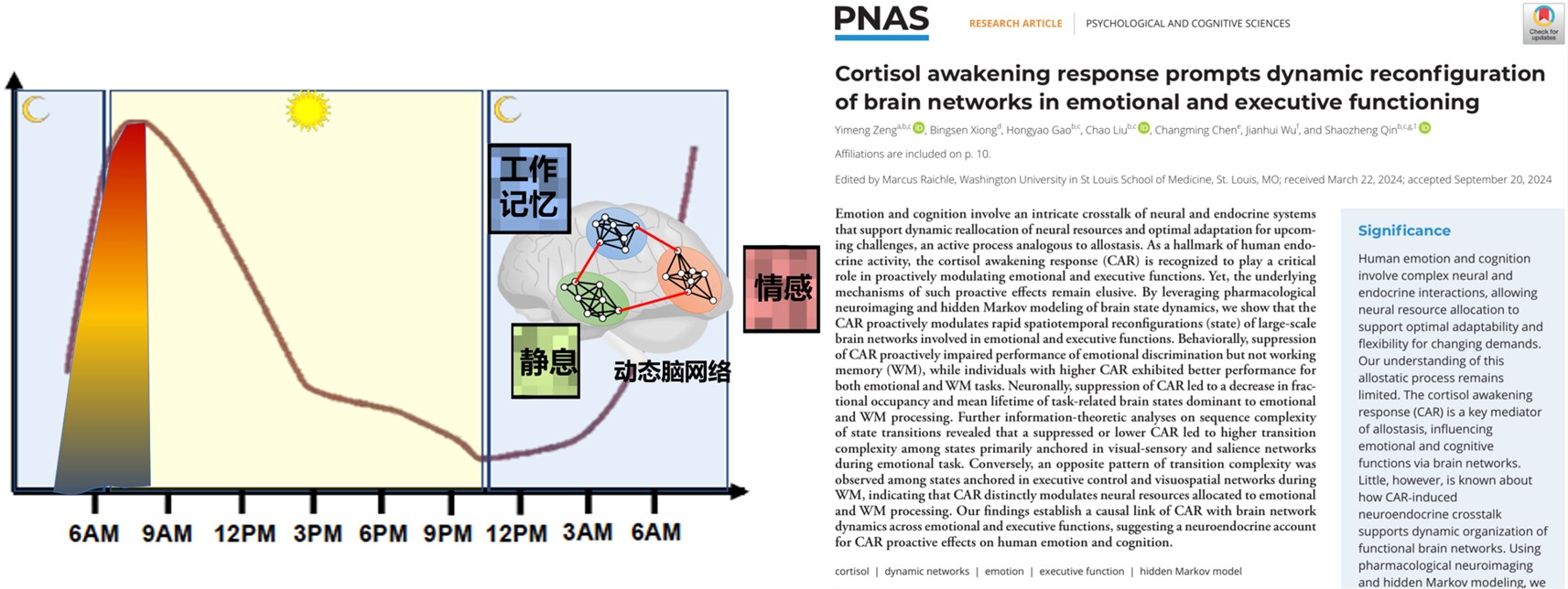
图1:皮质醇觉醒反应(Cortisol Awakening Response, CAR)
研究设计与主要结果的详细解读
人类压力觉醒反应CAR中的皮质醇水平上升,是维持大脑活动和情感认知功能的关键调质之一。神经生物学模型认为,皮质醇主要由肾上腺皮质束状带释放,可穿过血脑屏障影响神经兴奋性和脑网络的功能组织,促进个体应对环境挑战的适应性行为。它通过与神经系统中大量盐皮质激素受体(MR)和糖皮质激素受体(GR)结合,发挥着“快速(phasic)”和“慢速 (tonic)”两种不同作用,进而调节神经元兴奋/抑制平衡。据此可以推断,CAR可能有助于促进大脑情绪与执行控制相关脑网络资源的灵活分配。为此,皮质醇还可能通过与中枢分泌的神经递质(如儿茶酚胺)交互,调节全脑功能网络的动态活动,表现为大尺度脑网络的快速重组。结合课题组前期的研究积累,本研究进一步提出假设:CAR可能通过调节全脑网络动态重组进而影响情绪与控制功能,以支持应变稳态。
为了验证这一假设,该研究采用药物干预手段结合情绪与认知任务的实验范式,因果性地探究CAR是否影响个体在情绪识别任务与工作记忆任务中的行为表现(图2)。在此基础上,结合功能性磁共振成像(fMRI)与大尺度脑网络动态建模方法,探索CAR调节情绪与执行功能背后的潜在动态脑网络重组机制。在实验一中,研究团队采用随机、双盲的实验设计对皮质醇觉醒反应进行因果性操控,61名年轻健康男性被试在实验第1天20:00口服0.5mg地塞米松(DXM,药物组)或等量维生素C(Placebo,安慰剂组)。DXM可以模拟皮质醇到垂体促肾上腺皮质激素分泌细胞的负反馈进而起到抑制CAR的作用,因此可以抑制药物组被试第二天的晨起皮质醇觉醒反应。在第2天下午,所有被试在功能磁共振扫描期间完成连续的静息、情绪识别与工作记忆任务。与此同时,被试在实验期间的唾液样本也被收集用以测量任务期间的压力觉醒反应。此外,为了验证实验一的结果,研究团队还进行了非药物干预实验二,招募了59名年轻健康男性被试参与,进行与实验一一致的任务范式,并测量了被试在实验期间的压力觉醒反应的自然变化。研究团队首先验证了DXM组被试在第二天早上的CAR水平被成功抑制,验证了药物操纵的有效性。随后针对行为的分析,我们发现个体CAR水平越高,则被试的情绪识别与工作记忆任务的表现均显著更好,这在行为上确证了CAR对情绪识别与工作记忆存在正向支持作用。
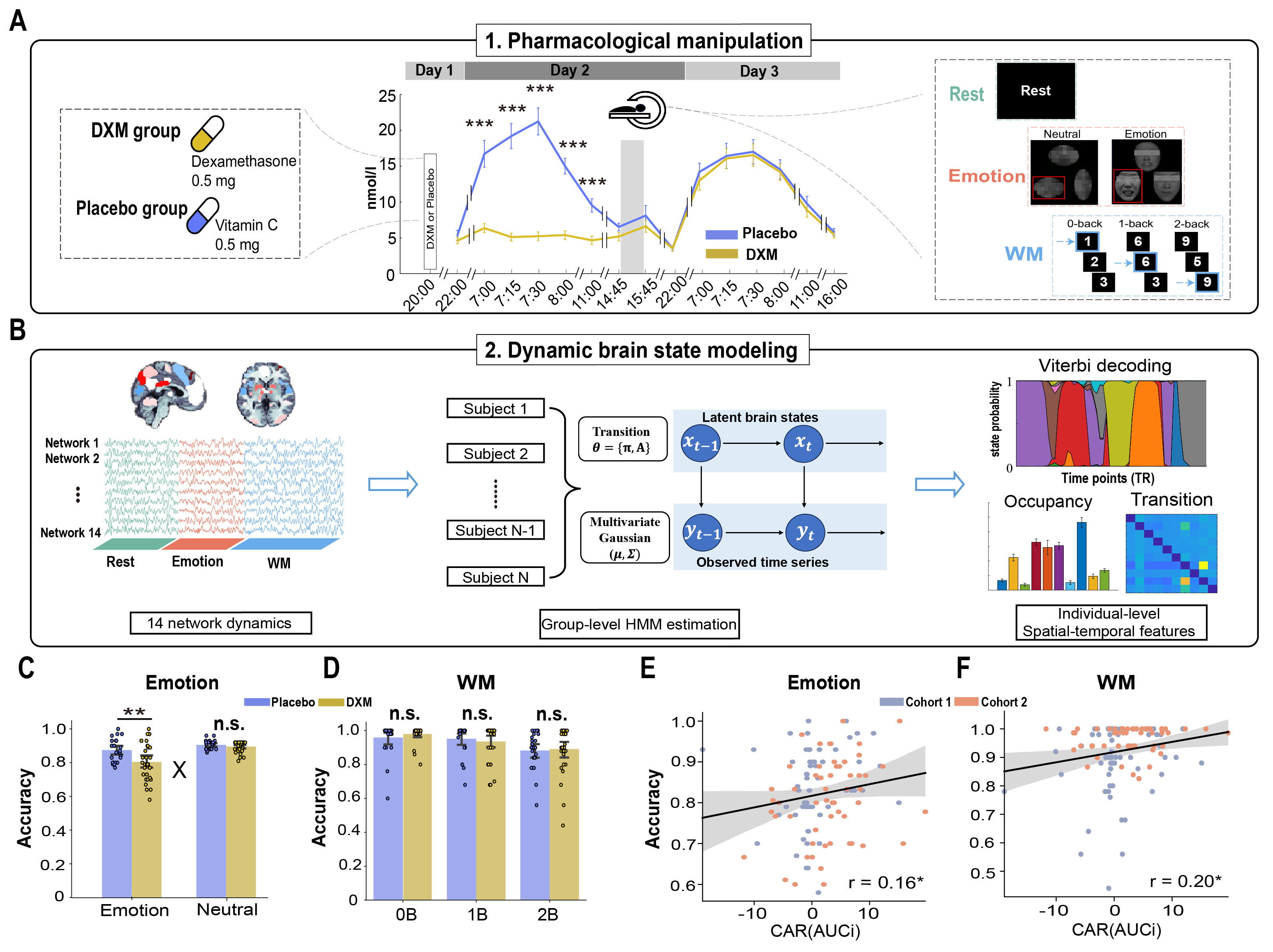
图2:药物操控实验流程结合多元任务的动态脑网络解码
在行为上验证了CAR对情绪识别与工作记忆的影响之后,研究团队进一步探究CAR是否显著改变了个体在进行任务时的脑网络的动态重组。采用基于隐马尔科夫模型构建的脑网络动态建模方法,研究团队对被试在进行任务期间的快速功能脑网络动态变化模式进行了识别,并解码出关键脑状态(brain state),并在此基础上测算了多种动态指标,包括状态出现比率、平均存活时间以及状态切换等。首先,研究团队发现在不同任务期间,大脑各功能网络形成了多种不同的脑状态(图3),这些脑状态在静息、情绪识别与工作记忆下有着显著不同的特征模式,其中状态1与状态8在情绪识别任务下占据主导,而状态4与状态5则在工作记忆任务下占据最多比例,而状态2与状态10则主要出现在静息状态下。此外,这些脑状态的特征表现为一组特定脑网络的激活,其中状态8表现为腹侧突显网络,基底核网络以及高级视觉网络的激活。与之相对的,状态5表现为双侧执行控制网络以及视觉空间网络的激活。最后,通过t-SNE方法将不同任务下的所有状态分布模式进行低维可视化,还发现所有状态联合的占比分布也受到任务的显著调节。
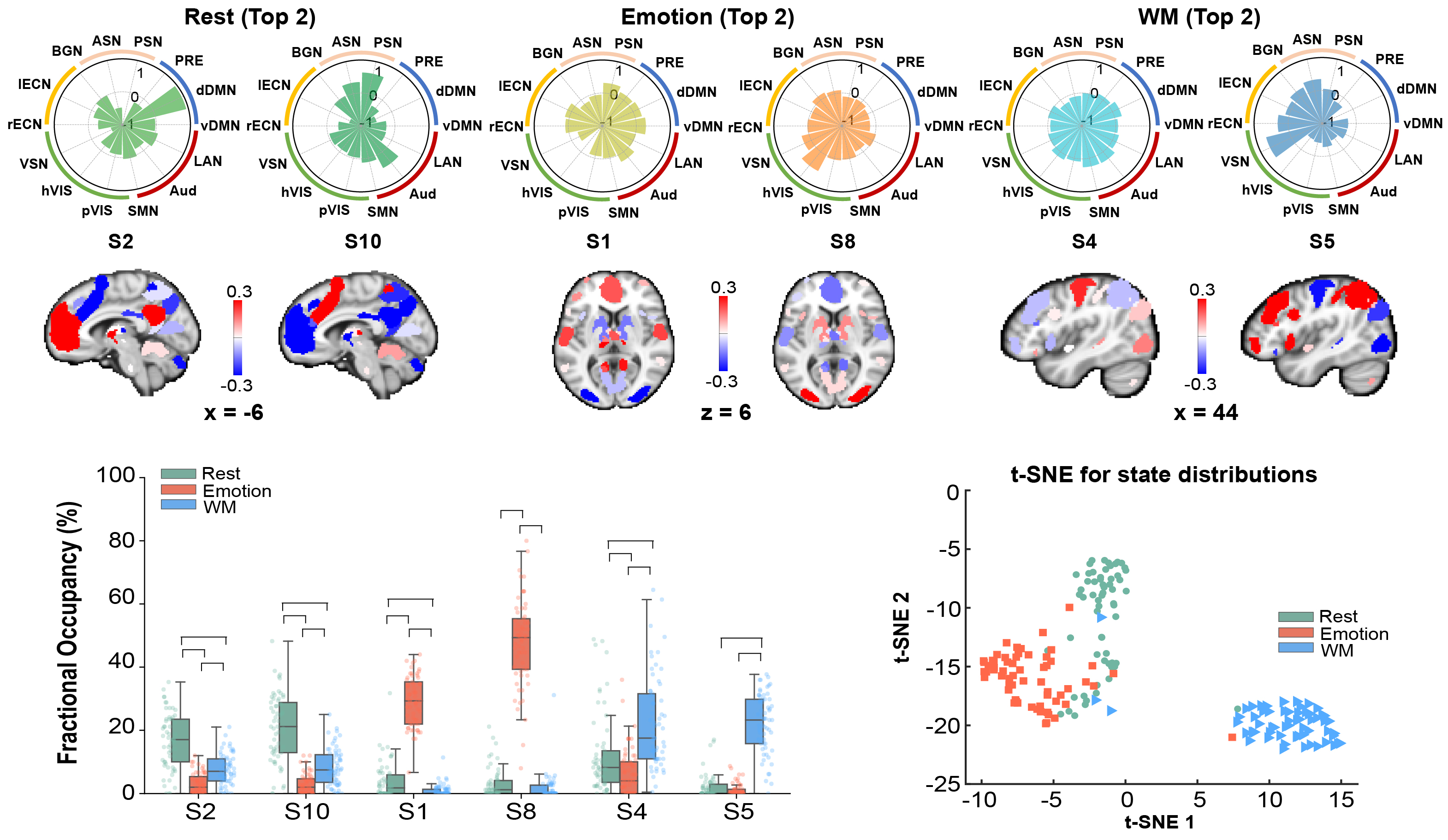
图3:解码的脑状态特征及在不同任务下的时空规律
在此基础上,研究团队通过拐点分析,识别出状态1与8为情绪任务中的核心状态,状态4与5为工作记忆任务中的核心状态(图4)。通过相关分析发现,这些核心状态的占比与个体在对应任务下的行为表现存在高度关联,其中状态8(核心情绪识别状态)出现比率越高,个体的情绪识别正确率越高,而状态4/5(核心工作记忆状态)出现比率越高,则分别与更低/更高的工作记忆的正确率相关。为了推断这些状态背后的潜在认知过程,研究团队采用基于大数据的反向推断方法识别出状态8与情绪识别任务下的情绪、面孔、注意等过程存在紧密关联,而状态5则与计算、数字等过程存在紧密关联,进一步确证了这些核心状态的认知意义。进一步的,我们探究了CAR是否影响了情绪与工作记忆下的核心脑状态的动态性,我们发现在情绪任务中药物抑制组(DXM组)的核心状态8的出现比率与平均存活时间均显著低于安慰剂组。而在工作记忆任务中,药物抑制组的核心脑状态4的出现比率与平均存活时间显著低于安慰剂组。通过构建该状态的神经效率指标,我们发现状态4的出现可能表征了一种高效的执行控制网络的激活模式,从而能以更低的执行控制网络激活完成高负荷工作记忆任务。至此,这些结果确证了CAR可以通过影响情绪与工作记忆下的核心脑状态的重组来支持情绪与执行功能。
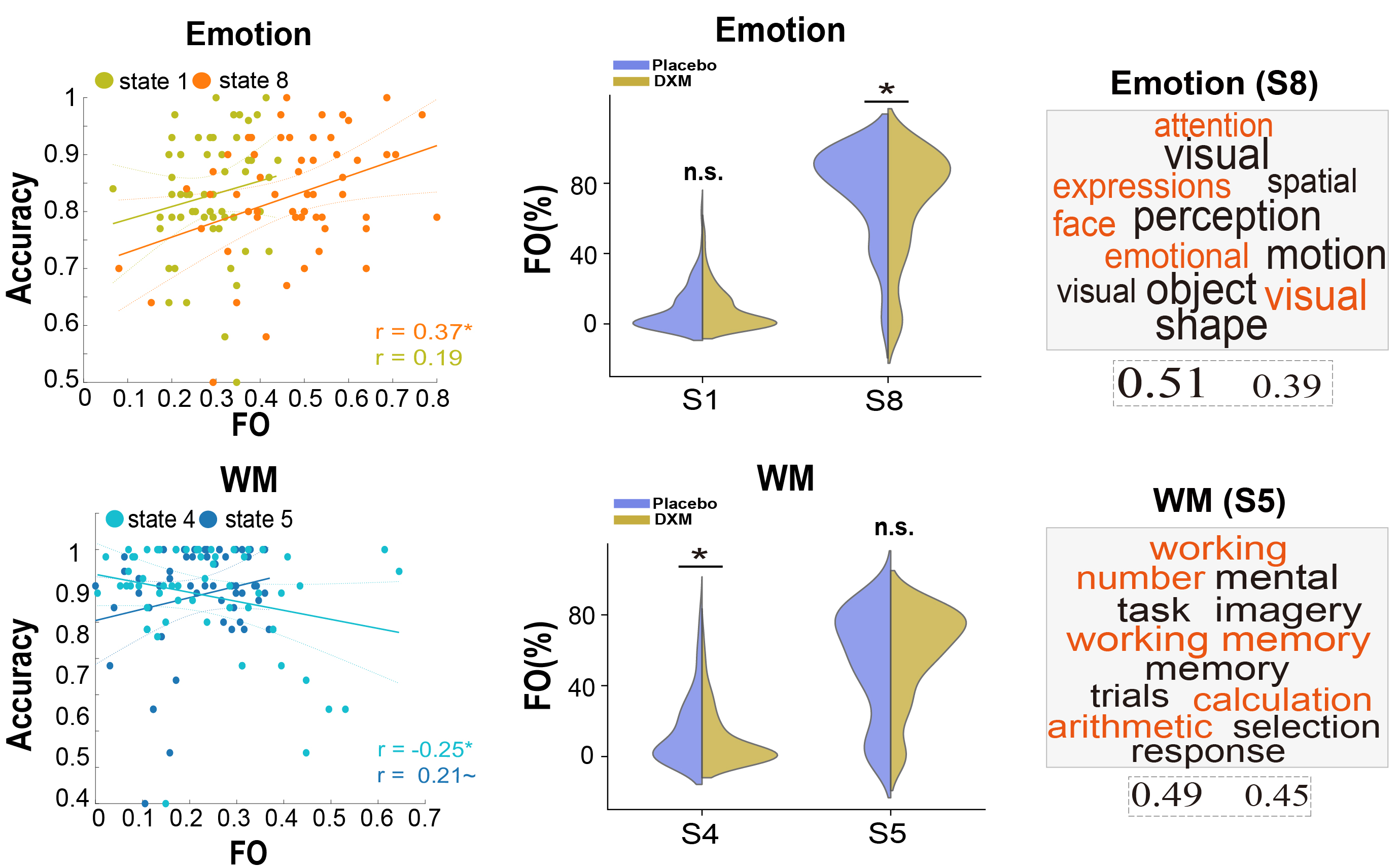
图4:CAR影响情绪识别与工作记忆任务下核心脑状态动态重组
最后,研究团队考察了CAR对不同状态间切换模式的影响,首先基于传统的状态切换概率矩阵进行分析,并未发现CAR与此的关联。之后,采用一种基于统计物理的宏观系统动态指标,即状态切换复杂度(transition complexity),从整体上测量不同任务下的整体状态切换模式(图5)。该指标在以往研究中被认为与系统神经资源分配以及神经信息编码模式间存在着密切关联。结果发现抑制或低水平的CAR显著提高情绪识别任务下的状态切换复杂度,而工作记忆下则相反,抑制或低水平CAR显著降低工作记忆任务下的状态切换复杂度。进一步的关联分析确证了这一模式:CAR水平越低或被抑制,则情绪识别任务下的状态切换复杂度越高;而在工作记忆条件下则相反,CAR水平越低或被抑制,则对应的状态切换复杂度也越低。总的来说,通过分析宏观视角下的状态切换复杂度,揭示了CAR通过灵活的神经资源分配(neural resource allocation),进而影响情绪与执行控制系统的特异性状态编码模式,最终支持了情绪识别与工作记忆的加工。
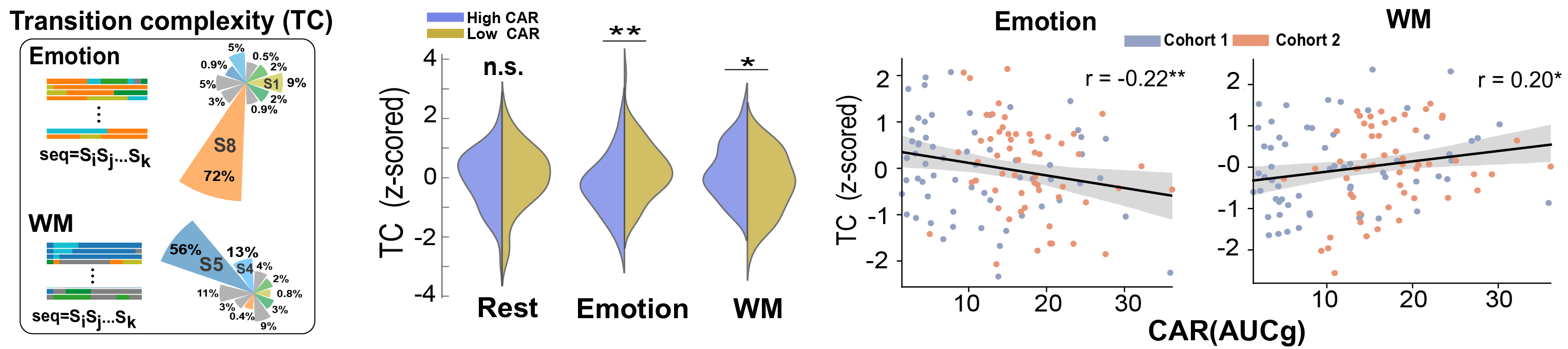
图5:CAR影响情绪识别与工作记忆下宏观状态转移复杂度
综上,本研究通过两个实验证实了压力觉醒反应CAR对大脑情绪与执行功能存在重要的支持作用。基于功能磁共振成像与脑网络动态分析方法,我们发现这种支持作用主要通过影响特定脑网络的动态功能重组模式,这一过程背后可能受到CAR激发的(MR/GR介导)的长时程(Tonic)效应与受到任务驱动的神经递质(如儿茶酚胺)的快速(Phasic)效应的协同作用影响,进而促进包括执行控制网络、突显网络等在内的全脑网络的快速重组。这些结果均反映出了CAR对帮助个体在复杂环境中保持高效的情绪和执行功能有着重要作用,有效支持了人体应变稳态的运行。研究结果为理解人体神经内分泌节律活动如何通过协同交互影响人体情感认知功能与神经脑网络重组有较为重要的意义,对临床上开发用于改善神经内分泌调控的方法以及一般生活中如何促进学习工作效率及保持身心健康有重要的启示。
课题组网站:http://icanbrainlab.bnu.edu.cn
论文信息:Zeng, Y., B. Xiong, H. Gao, C. Liu, C. Chen, J. Wu and S. Qin (2024). "Cortisol awakening response prompts dynamic reconfiguration of brain networks in emotional and executive functioning."Proceedings of the National Academy of Sciences 121(52): e2405850121, www.pnas.org/doi/10.1073/pnas.2405850121
课题组前期相关论文:
1. Xiong, B., C. Chen, Y. Tian, S. Zhang, C. Liu, T. M. Evans, G. Fernández, J. Wu and S. Qin (2021). "Brain preparedness: The proactive role of the cortisol awakening response in hippocampal-prefrontal functional interactions." Progress in Neurobiology 205: 102127.
2. Tian, T., C. B. Young, Y. Zhu, J. Xu, Y. He, M. Chen, L. Hao, M. Jiang, J. Qiu, X. Chen and S. Qin (2021). "Socioeconomic Disparities Affect Children’s Amygdala-Prefrontal Circuitry via Stress Hormone Response." Biological Psychiatry 90(3): 173-181.
3. Zhu, Y., X. Chen, H. Zhao, M. Chen, Y. Tian, C. Liu, Z. R. Han, X. Lin, J. Qiu, G. Xue, H. Shu and S. Qin (2019). "Socioeconomic status disparities affect children’s anxiety and stress-sensitive cortisol awakening response through parental anxiety." Psychoneuroendocrinology 103: 96-103.
4. Zeng, Y., F. Tao, Z. Cui, L. Wu, J. Xu, W. Dong, C. Liu, Z. Yang and S. Qin(2021). "Dynamic integration and segregation of amygdala subregional functional circuits linking to physiological arousal." Neuroimage: 118224.
5. Wang, H., X. Wu, J. Xu, R. Zhu, S. Zhang, Z. Xu, X. Mai, S. Qin and C. Liu (2024). "Acute stress during witnessing injustice shifts third-party interventions from punishing the perpetrator to helping the victim." PLOS Biology 22(5): e3002195.
6. Wu, J., S. Zhang, W. Li, S. Qin, Y. He, Z. Yang, T. W. Buchanan, C. Liu and K. Zhang (2015). "Cortisol awakening response predicts intrinsic functional connectivity of the medial prefrontal cortex in the afternoon of the same day." Neuroimage122: 158-165.
7. Wang, H., S. Zhang, S. Wu, S. Qin and C. Liu (2022). "Cortisol awakening response and testosterone jointly affect adolescents' theory of mind." Hormones and behavior 146: 105258.