【论文】自闭症基因Mecp2调控大脑发育“关键期”可塑性
2014年10月9日,《自然—通讯》(Nature Communications)发表了北京师范大学认知神经科学与学习国家重点实验室章晓辉教授课题组关于自闭症谱系疾病Rett综合症基因Mecp2(Methyl-CpG-binding protein 2)调控大脑发育“关键期”可塑性的研究发现。
Rett综合症发病于女孩,主要由X染色体上编码甲基化CpG结合蛋白(MeCP2) 的基因突变缺失所引发。 患者在出生后6-18个月内脑发育基本正常,随后出现发育停滞并逐渐表现出运动异常、语言和认知功能退化和自闭行为等症状。此类发育性疾病一直以来被认为是由于脑内神经细胞连接(突触)功能异常所导致。然而对Mecp2缺失如何导致异常的突触环路发育和功能仍不清楚。 在这项研究中,博士生何灵杰利用分子遗传技术在小鼠脑内不同类型神经元中特异性敲除致病基因Mecp2,发现在一类表达小清蛋白(parvalbumin, PV)并释放抑制性递质g-氨基丁酸(GABA)的中间神经元中敲除Mecp2基因可导致视觉皮层 “关键期”可塑性缺失。她与合作者刘楠等进一步通过在体和脑薄片电生理记录、细胞显微成像与功能基因表达分析等方法阐明了“关键期”可塑性缺失的神经环路机制和分子基础: PV细胞中Mecp2缺失选择性地减弱了皮层抑制性GABA环路中特定突触的功能,并特异地降低了脑内GABA功能相关 的基因(Gad2, Parvalbumin, Gabra1, Gabra2, Kv3.1和Glur3)的表达。这一系列实验结果表明,PV细胞中Mecp2缺失特别损害了大脑皮层抑制性神经环路,进而导致 “关键期”可塑性的缺失。与之相应,实验者在Mecp2缺失的小鼠大脑内注入增强GABA抑制功能的药物(diazepam, 地西泮)可以完全恢复“关键期”可塑性。这些实验发现揭示了自闭症相关蛋白MeCP2在维持大脑抑制性突触环路功能完整性和调控“关键期”可塑性中新的重要功能。
“关键期”可塑性是脑内各种功能性突触环路对环境和经验做出适应性的优化过程,是大脑正常建立感知觉、语言与学习等功能中一个必要环节。该项研究发现也表明神经发育疾病基因所导致的“关键期”可塑性缺失可能参与此类疾病的发生和发展,并所揭示的MeCP2调控“关键期”可塑性的GABA环路机制可为干预自闭症谱系疾病提供可能靶点。
此项研究得到科技部“人类智力的神经基础”973项目(2011CBA00403)资助。章晓辉教授课题组陈小菁博士和博士生李一丁、中科院神经科学所仇子龙研究员和程田林博士、以及北京师范大学脑与认知院舒友生教授共同参与了研究。
相关联接:He L-j., Liu N., Chen T-l., Chen X-j., Li Y-d., Shu Y-s.,Qiu Z-l., and Zhang X-h. (2014) Conditional deletion of Mecp2 in parvalbumin-expressing GABAergic cells results in the absence of critical period plasticity. Nat. Commun. 5:5036 doi: 10.1038/ncomms6036.
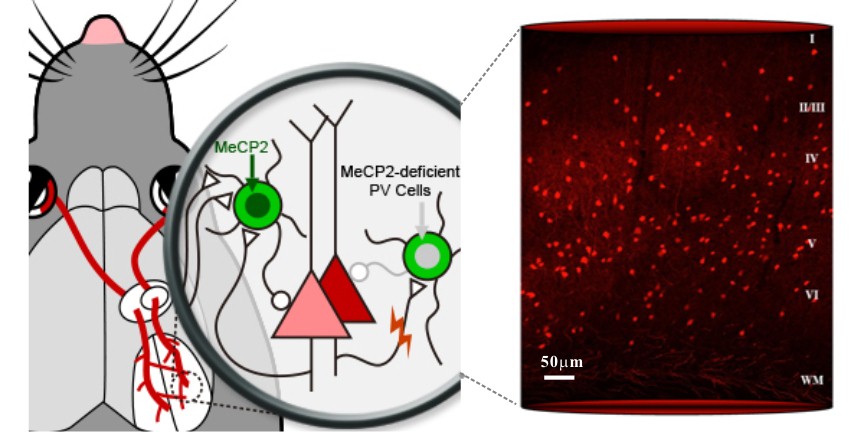
图:左,自闭症谱系疾病相关基因
Mecp2在大脑内一类表达小清蛋白(PV) 的抑制性中间神经元的表达在维持视皮层的抑制性突触环路功能完整性与调控“关键期”可塑性中发挥关键作用。右,红色荧光蛋白标示的小鼠感觉皮层PV神经元网络。
