2024年9月18日,北京师范大学认知神经科学与学习国家重点实验室贺永、廖旭红及合作者在PLoS Biology在线发表题为“Functional network modules overlap and are linked to interindividual connectome differences during human brain development”。该研究综合采用纵向多模态磁共振扫描数据,揭示了儿童青少年脑功能网络重叠模块的时空发育规律及其结构基础(Lei et al., 2024)。
儿童青少年期是个体从婴儿期到成年期的过渡阶段,解析这一关键阶段的脑发育规律对于理解个体认知与行为发展的神经机制至关重要。近二十年来,基于神经影像的脑连接组学研究为探索脑结构与功能的发育规则提供了重要的计算框架(Cao et al., 2017; Wang et al., 2024)。研究表明,人脑功能网络呈现模块化组织,这一架构对于脑网络实现分离与整合的平衡起到关键作用。贺永课题组近期研究发现,人脑功能网络模块内和模块间的功能连接强度随年龄显著变化,促进了脑网络分离与整合向着优化平衡的方向发育(Li et al.,2024)。然而,以往脑网络发育理论和计算框架大都假定每个脑节点仅属于一个特定的功能模块,忽视了脑节点的功能模块归属的多样性和复杂性。
本研究基于认知神经科学与学习国家重点实验室与北京大学、北京回龙观医院合作建立的“学龄儿童脑发育与学校适应”北京队列数据,采用305名健康儿童青少年(基线年龄:6-12岁,间隔1年随访)的纵向多模态磁共振影像数据(包括静息态、结构以及弥散磁共振)。该研究基于团队前期绘制的中国儿童青少年脑发育模板图谱(Zhao et al., 2019),采用边中心(edge-centric)网络模型检测前沿计算框架,识别了人脑功能网络重叠模块化架构(图1),并采用熵测度量化了脑区功能模块重叠特性的程度及其发育规律。研究发现,在儿童青少年期脑功能网络呈现空间重叠的模块化架构,脑节点功能模块归属的重叠程度呈现区域异质性,其中腹侧注意、感觉运动和皮层下区域的重叠程度较高(即熵较高),而视觉和默认模式区域的重叠程度较低(即熵较低)(图2)。功能模块重叠特性随年龄的发展变化主要表现为背内侧前额叶皮层、腹侧前额叶皮层和苍白球的重叠程度线性下降,而顶下小叶和外侧前额叶皮层的重叠程度线性上升(图3)。基于NeuroSynth数据库的认知功能关联解析,发现功能模块重叠程度随年龄显著增加的脑区主要涉及运动想象、视觉感知等功能,而随年龄显著下降的脑区主要涉及言语、词汇形成以及听觉等功能(图4)。最后,考虑到儿童青少年脑灰质和白质结构的渐进成熟(Liang et al., 2024),该研究发现整合脑灰质形态和白质微结构特征能够显著预测个体脑功能模块重叠程度的空间模式,其中皮层厚度在预测模型中起到重要贡献(图5)。本研究阐释了儿童青少年脑功能网络重叠模块的发育规律及其结构基础,凸显了脑功能重叠模块发育的认知意义。该研究不仅对于理解儿童青少年认知发展的神经机制具有重要价值,而且为神经精神疾病的脑网络异常发育机制研究和个体评估方法提供了新视角。
该论文的第一作者为贺永课题组博士毕业生雷天缘(现为北京儿童医院精神科助理研究员),通讯作者为贺永教授和系统科学学院的廖旭红副教授。论文合作者包括来自北京大学的高家红教授团队、北京回龙观医院的谭淑平教授团队以及北京师范大学的董奇教授、陶沙教授、秦绍正教授等。该研究得到了国家自然科学基金创新研究群体、科技部重点研发课题、北京市脑计划等项目的资助。
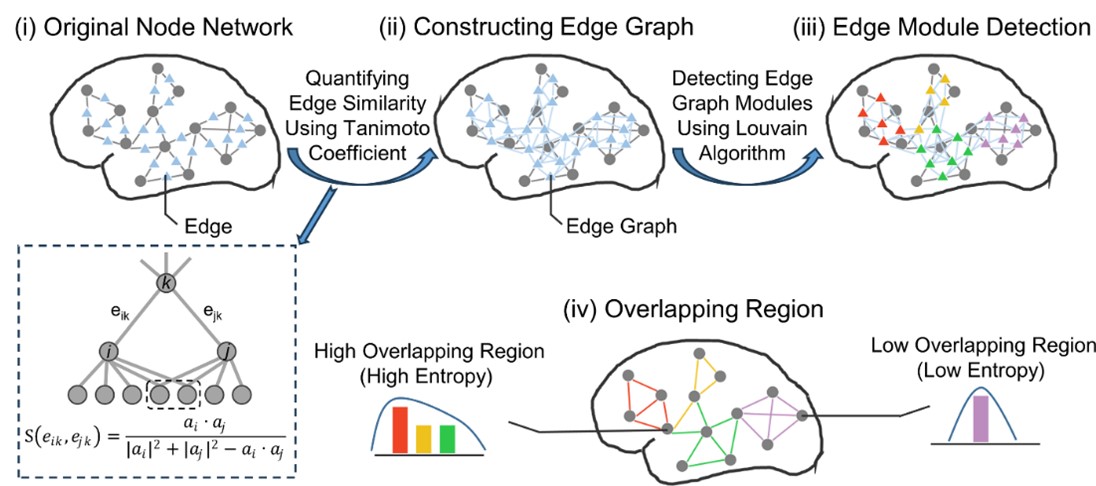
图1.脑功能网络重叠模块识别以及脑节点功能模块重叠特性的示意图
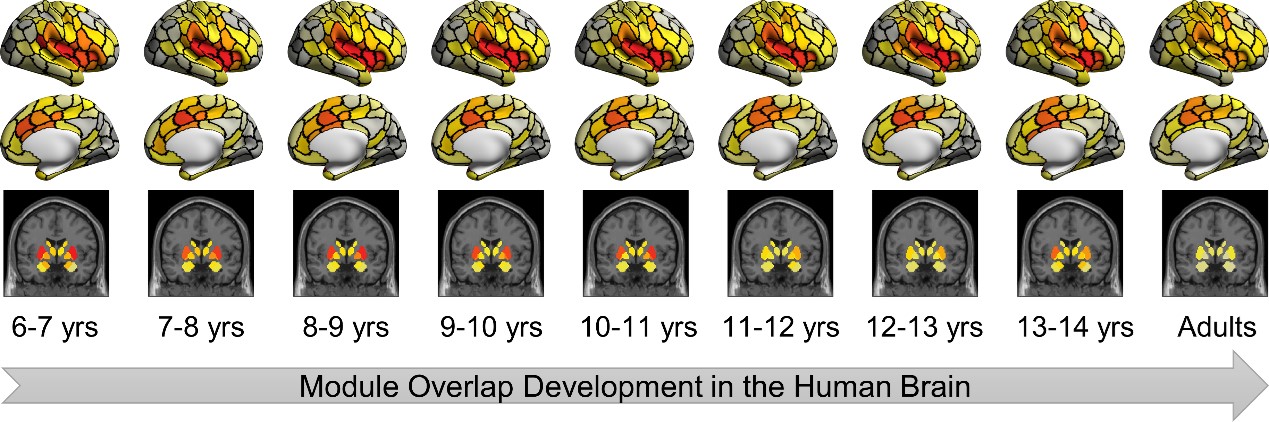
图2. 儿童青少年期脑功能网络模块重叠特性的空间分布图
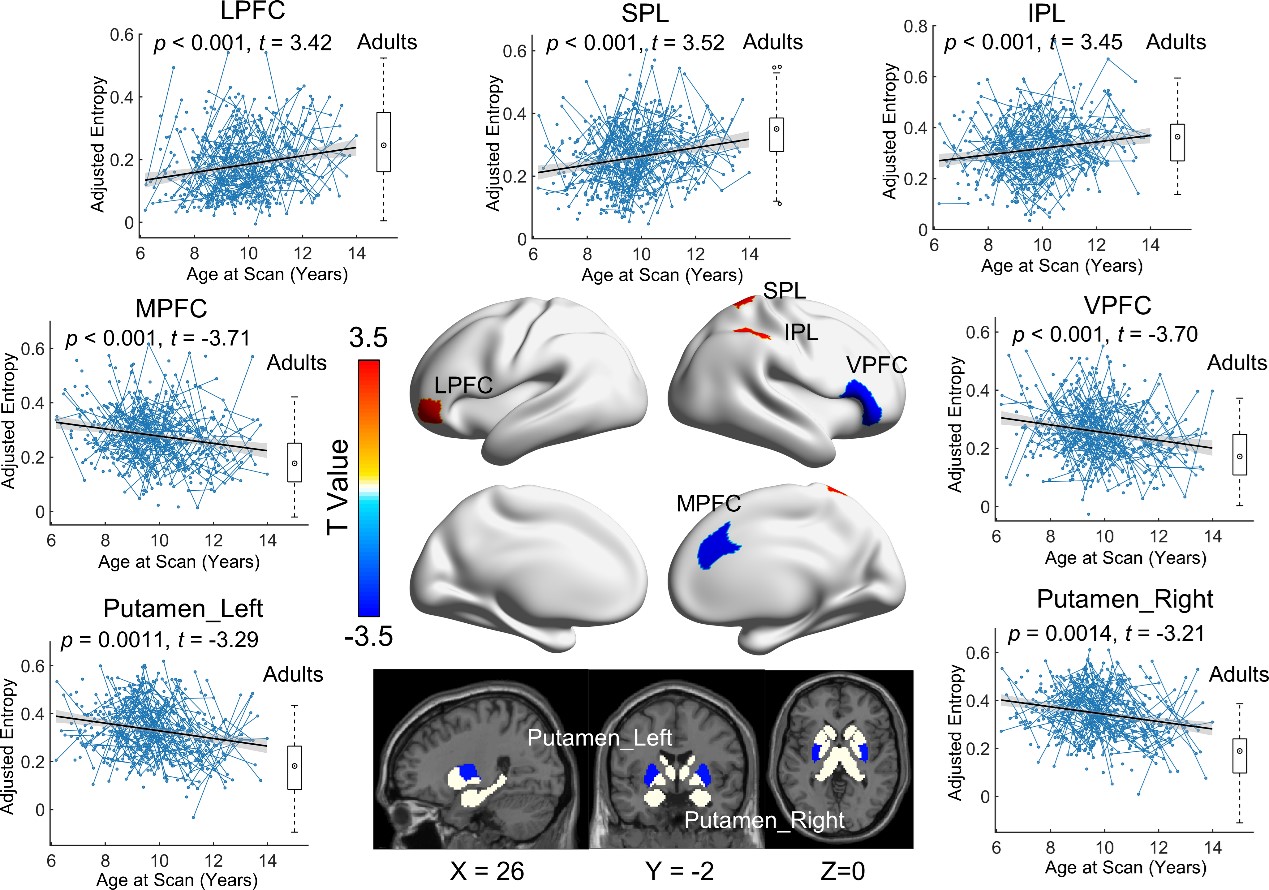
图3. 儿童青少年时期脑功能网络模块重叠特性的发育规律
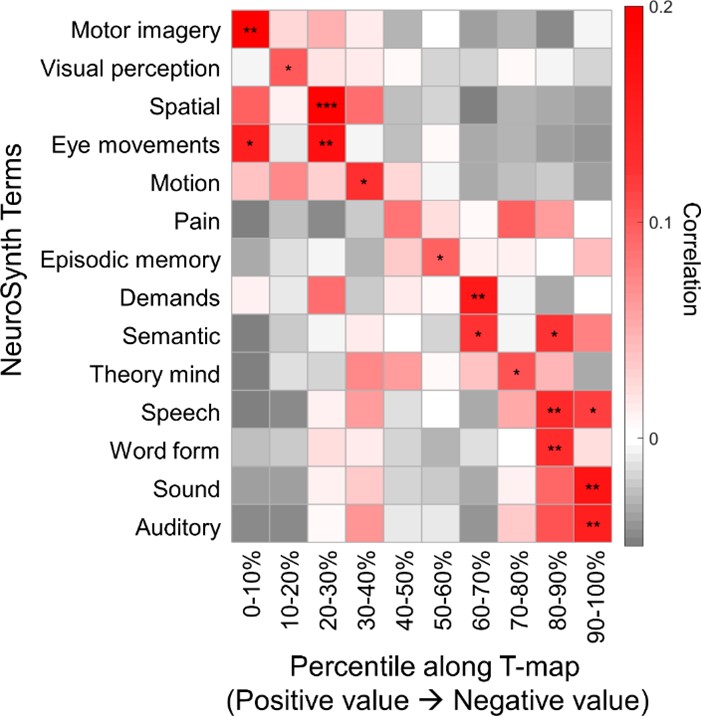
图4. 儿童青少年时期脑功能网络模块重叠特性发育变化的认知意义
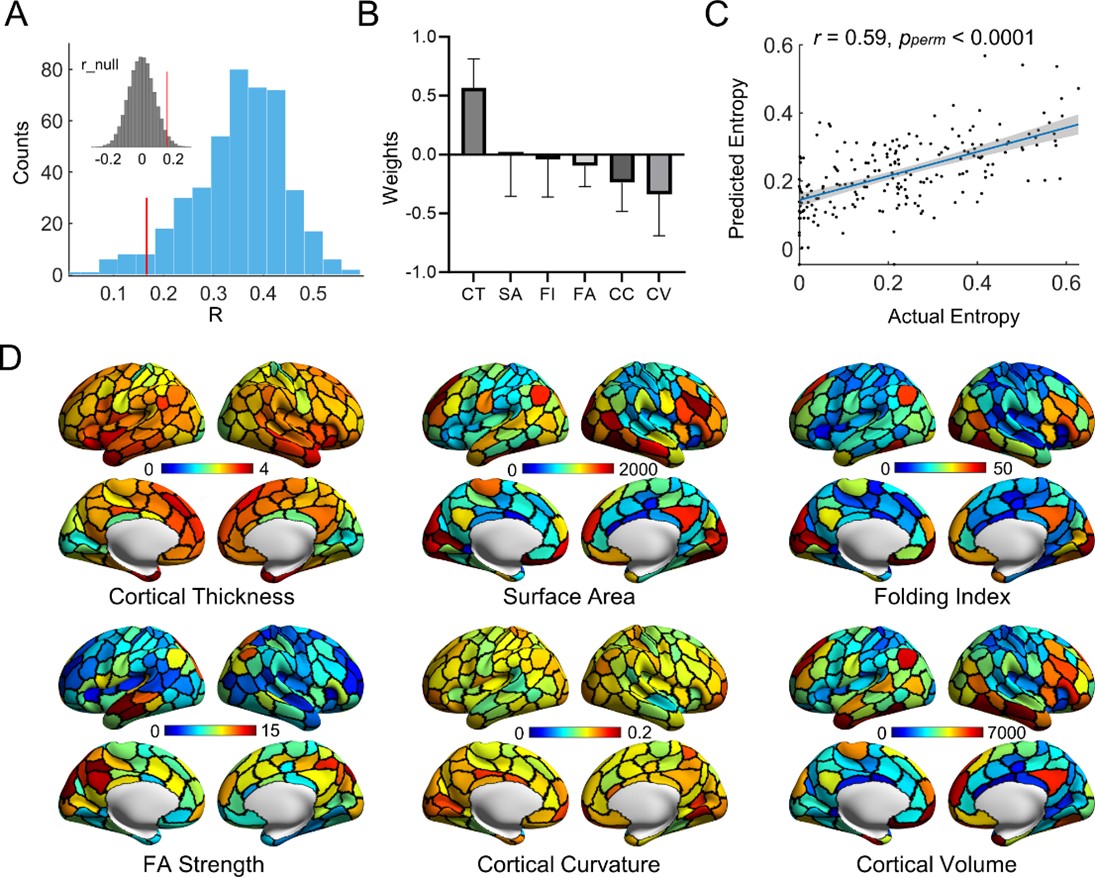
图5. 脑结构特征对个体功能网络模块重叠特性的空间分布模式的预测
论文链接:
https://journals.plos.org/plosbiology/article?id=10.1371/journal.pbio.3002653
贺永课题组主页:
参考文献:
1. Lei T, Liao X, Liang X, Sun L, Xia M, Xia Y, Zhao T, Chen X, Men W, Wang Y, Ma L, Liu N,Lu J, Zhao G, Ding Y, Deng Y, Wang J, Chen R, Zhang H, Tan S, Gao J, Qin S, Tao S, Dong Q, He Y (2024) Functional network modules overlap and are linked to interindividual connectome differences during human brain development. PLoS Biology, 22(9): e3002653.
2. Liang X, Sun L, Liao X, Lei T, Xia M, Duan D, Zeng Z, Xu Z, Men W, Wang Y, Tan S, Gao J, Qin S, Tao S, Dong Q, Zhao T, He Y (2024) Structural connectome architecture shapes the maturation of cortical morphology from childhood to adolescence. Nature Communications, 15,784:1-18.
3. Wang J, He Y (2024) Toward individualized connectomes of brain morphology. Trends in Neurosciences 47(2):106-119.
4. Cao M, Huang H, He Y (2017) Developmental connectomics from infancy through early childhood. Trends in Neurosciences 40:494-506.
5. Li Q, Xia M, Zeng D, Xu Y, Sun L, Liang X, Xu Z, Zhao T, Liao X, Yuan H, Liu Y, Huo R, Li S, He Y (2024) Development of segregation and integration of functional connectomes during the first 1,000 days. Cell Reports, 43,5.
6. Zhao T, Liao X, Fonov V, Wang Q, Men W, Wang Y, Qin S, Tan S, Gao J, Evans A, Tao S, Dong Q, He Y (2019) Unbiased age-specific structural brain atlases for Chinese pediatric population. NeuroImage, 189:55-70.